
Artículo de investigación
Evaluación de respuesta a tratamientos con inmunoterapia y contra diana molecular en cáncer de pulmón
Evaluation of response to immunotherapy and molecular targeting treatments in lung cancer
Lisandry
Alonso Lemus1 http://orcid.org/0000-0002-2986-1790
Kirenia
Camacho Sosa1 http://orcid.org/0000-0003-0497-7647
Lilianys
Arias Correa1 http://orcid.org/0009-0007-8855-2924
Carmen
Elena Viada González2 https://orcid.org/0000-0002-1604-3545
Junior
Vega Jiménez3* https://orcid.org/0009-0003-0734-2847
Humberto Alexis López González4 https://orcid.org/0000-0002-8474-3842
1Hospital
Provincial Clínico Quirúrgico Docente "Faustino Pérez".
Matanzas, Cuba.
2Centro
de inmunología Molecular. La Habana, Cuba.
3Hospital
Militar "Dr. Mario Muñoz Monroy". Matanzas, Cuba.
4Universidad
de Ciencias Médicas de Matanzas. Matanzas, Cuba.
*Autor para la correspondencia: drjrvega@gmail.com

RESUMEN
Introducción:
El cáncer de pulmón de células no pequeñas es objeto
de investigación en tratamientos de precisión.
Objetivo: Evaluar la respuesta a los tratamientos con inmunoterapia y
contra diana molecular en el cáncer de pulmón de células
no pequeñas.
Métodos: Se realizó un estudio de evaluación analítico,
longitudinal y prospectivo en pacientes diagnosticados con cáncer de
pulmón de células no pequeñas, desde abril de 2020 hasta
marzo de 2024. Se recopiló información de historias clínicas
y se incluyeron datos demográficos, tabaquismo, histología, etapa
clínica, estado del receptor del factor de crecimiento epidérmico
y tratamientos recibidos (inmunoterapia o inhibidores de la tirosina quinasa).
La respuesta al tratamiento se evaluó según los criterios RECIST.
Se dividieron los pacientes en dos grupos, de acuerdo al estado de la mutación
del receptor del factor de crecimiento epidérmico, para recibir tratamiento.
El análisis estadístico se realizó mediante el programa
SPSS, versión 25.
Resultados:
El subtipo histológico predominante fue el carcinoma epidermoide (50,9
%). La etapa IVA fue la más frecuente al momento del diagnóstico
(52,6 %). La inmunoterapia más utilizada fue Cimavax-EGF (45,0 %). Con
atezolizumab, la mejor respuesta fue respuesta parcial (66,7 %) a los tres meses.
Con Cimavax-EGF predominó la respuesta completa (61,4 %), a los seis
meses. En cuanto a los tratamientos con TKI, a los tres meses predominó
la respuesta parcial (41,7 %).
Conclusiones: En estadios avanzados de cáncer de pulmón
de células no pequeñas, los pacientes tratados con inhibidores
de la tirosina quinasa mostraron mejor respuesta objetiva con gefitinib, mientras
que osimertinib ofreció un control superior de la enfermedad. Respecto
a la inmunoterapia, atezolizumab demostró la mejor respuesta objetiva
y control de la enfermedad, seguido por nimotuzumab.
Palabras clave: Neoplasias pulmonares; carcinoma pulmonar de células pequeñas; antineoplásicos inmunológicos; estudio de evaluación; inmunoterapia.
ABSTRACT
Introduction:
Non-small cell lung cancer (NSCLC) is the subject of research in precision treatments.
Objective: To evaluate the response to immunotherapy and molecular anti-target
treatments in non-small cell lung cancer.
Methods: An analytical, longitudinal and prospective evaluation study
was conducted in patients diagnosed with NSCLC from April 2020 to March 2024.
Information including demographic data, smoking habit, histology, clinical stage,
EGFR status, and treatments received (immunotherapy or TKI) was collected from
medical records. Response to treatment was assessed according to RECIST criteria.
Patients were divided into two groups according to the EGFR mutation status
to receive treatment. Statistical analysis was performed using SPSS version
25.
Results:
The predominant histological subtype was squamous cell carcinoma (50.9 %). Stage
IVA was the most frequent at diagnosis (52.6 %). The most commonly used immunotherapy
was Cimavax-EGF (45.0 %). With atezolizumab, the best response was PR (66.7
%) at three months. With Cimavax-EGF, CR predominated (61.4 %) at six months.
Regarding TKI treatments, partial response (PR) predominated at three months
(41.7 %).
Conclusions: In advanced stages of NSCLC, patients treated with TKI showed
a better objective response with gefitinib, while osimertinib offered superior
disease control. Regarding immunotherapy, atezolizumab demonstrated the best
objective response and disease control, followed by nimotuzumab.
Keywords: Lung neoplasms; small cell lung carcinoma; immunological antineoplastic agents; evaluation study; immunotherapy.
Recibido:
09/02/2025.
Aprobado: 09/04/2025.
INTRODUCCIÓN
El cáncer de pulmón (CP) representa un desafío significativo a nivel global, a pesar de los avances logrados en tratamientos aplicados durante las últimas dos décadas. Además, en Cuba, esta enfermedad constituye una de las principales causas de mortalidad por tumores malignos. En este contexto, el cáncer de pulmón de células no pequeñas (CPCNP) -que abarca el 85 % de los casos-, se caracteriza por un polimorfismo genético y es objeto de intensa investigación en tratamientos de precisión.(1,2,3)
El enfoque terapéutico se basa en el diagnóstico histológico, el estadio de la enfermedad y la evaluación de la capacidad funcional de cada paciente. Por ende, las principales estrategias oncológicas incluyen tanto a la cirugía, como a la quimioterapia y la radioterapia, así como a terapias dirigidas hacia moléculas específicas y la inmunoterapia. Además, la evaluación de la eficacia del tratamiento se realiza mediante los criterios RECIST 1.1 (Response Evaluation Criteria in Solid Tumors),(4) que son reconocidos a nivel internacional y utilizados en ensayos clínicos.(5)
La aplicación de los criterios RECIST 1.1 requiere la definición inicial de lesiones diana representativas y reproducibles. Sin embargo, la variabilidad y la dificultad de medición pueden generar discrepancias. Por otro lado, la valoración de la respuesta se lleva a cabo mediante la utilización de la misma técnica empleada en el estudio inicial. Además, se considera la duración de la respuesta junto con la suma de las lesiones diana del estudio basal. Los resultados del RECIST(4,6) varían según el tratamiento: mientras que la quimioterapia ataca las células en diferentes fases del ciclo celular, la inmunoterapia estimula el sistema inmunitario para combatir el tumor de forma selectiva. Por último, los fármacos contra diana molecular actúan sobre genes específicos con alteraciones.(7,8,9,10)
Basados en los elementos antes expresados, se plantea como objetivo de la investigación el evaluar la respuesta a los tratamientos con inmunoterapia y contra diana molecular en el cáncer de pulmón de células no pequeñas.
MÉTODOS
Se llevó a cabo un estudio analítico, longitudinal y prospectivo. Esto implica que los investigadores observaron a los pacientes a lo largo del tiempo para evaluar los resultados del tratamiento y la evolución de la enfermedad. La población estuvo compuesta por todos los pacientes diagnosticados con cáncer de pulmón de células no pequeñas, mediante citohistología, registrados en el Servicio Provincial de Oncología de Matanzas, entre el 1 de abril de 2020 y el 31 de marzo de 2024.
El universo del estudio incluyó a 294 pacientes. Fue seleccionada una muestra de 114 pacientes que cumplieron con los criterios mencionados. Se tuvieron en cuenta los siguientes criterios de inclusión:
Criterios de exclusión:
Los pacientes fueron seguidos durante un período que abarca desde su diagnóstico hasta la finalización del tratamiento, así como en intervalos regulares para evaluar la respuesta al tratamiento y cualquier efecto secundario. El seguimiento tuvo como objetivos:
Este
estudio se enmarca dentro del proyecto institucional NA793MT517, centrado en
el impacto del diagnóstico, tratamiento y seguimiento del cáncer
de pulmón, en el contexto de la COVID-19 en Matanzas. Dicho proyecto
está auspiciado por el Hospital Provincial Clínico Quirúrgico
Docente "Faustino Pérez" y a la Universidad de Ciencias Médicas
de Matanzas.
El estudio recopiló información de historias clínicas de pacientes con cáncer de pulmón de células no pequeñas (CPCNP), para analizar diversas variables y la relación con el tratamiento y la respuesta. Las variables consideradas fueron:
• Edad: Se registró la edad en años cumplidos al momento del diagnóstico, obtenida directamente de las historias clínicas.
• Sexo: Se categorizó como masculino o femenino, basado en el registro en las historias clínicas.
• Color de la piel: Se clasificó a los pacientes en tres grupos: blanca, negra o mestiza, según la información disponible en sus historias clínicas.
• Adicción tabáquica: Esta variable se definió de acuerdo a los criterios de la OMS(11): fumador (persona que ha fumado todos los días durante el último mes cualquier cantidad de cigarrillos, incluso uno), exfumador (persona fumadora que no ha consumido tabaco en los últimos seis meses) o no fumador (nunca ha fumado). Se utilizó la información proporcionada por los pacientes y registros médicos.
• Histología: Se identificaron los tipos histológicos presentes, incluyendo carcinoma epidermoide, adenocarcinoma (ADC), carcinoma adenoescamoso, carcinoma de células grandes y cáncer de pulmón de células no pequeñas no especificado, a partir de análisis histopatológicos realizados en biopsias.
• Estado funcional: Se midió mediante la utilización de la escala ECOG (Eastern Cooperative Oncology Group), que clasifica el estado funcional del paciente en una escala del 0 al 4, donde 0 indica que el paciente está completamente activo y 4 indica que está postrado en cama.
• Etapa clínica: La clasificación se realizó de acuerdo al sistema TNM (tumor, nódulo, metástasis), al categorizar a los pacientes en estadios IA, IB, IIA, IIB, IIIA, IIIB, IIIC, IVA y IVB basada en hallazgos clínicos y radiológicos.
• Estado del EGFR (Receptor del factor de crecimiento epidérmico): Se determinó mediante pruebas de mutación del EGFR, con la utilización de la reacción en cadena de la polimerasa (PCR). Los resultados clasificaron a los pacientes como mutados o no mutados.
• Tratamiento recibido: Se registraron los tratamientos administrados, que incluían inmunoterapia (al especificar atezolizumab, CIMAvaxEGF, nimotuzumab y racotumumab) o inhibidores de tirosina quinasa (TKI) como gefitinib u osimertinib. Esta información fue extraída de las historias clínicas.
• Respuesta al tratamiento: Se evaluó mediante criterios clínicos que clasifican la respuesta como respuesta completa (RC), respuesta parcial (RP), enfermedad estable (EE), enfermedad en progresión (EP) o no evaluable (NE).
• Respuesta objetiva: Se definió como la combinación de RC + RP para respuesta positiva y EE + EP para respuesta negativa según los criterios RECIST (Response Evaluation Criteria in Solid Tumors).
• Control de la enfermedad: Se consideró como la combinación de RC + RP + EE y EP también según criterios RECIST.
Procedimientos
1. Recolección de datos: Se obtuvo información de las historias clínicas de los pacientes.
2. Prueba de mutación del receptor del factor de crecimiento epidérmico: Se realizó una prueba de reacción en cadena de la polimerasa (PCR) para detectar la mutación del receptor del factor de crecimiento epidérmico, en la totalidad de los pacientes.
3. División de grupos de tratamiento: Los pacientes se dividieron en dos grupos según el estado de la mutación del receptor del factor de crecimiento epidérmico para recibir tratamiento:
• No mutados: Recibieron tratamiento con inmunoterapia, que incluyó CIMAvaxEGF (en estadios iniciales con progresión a enfermedad metastásica y alta concentración de EGF), nimotuzumab (en estadios IIIB a IVB con RP o enfermedad estable después de la primera línea y baja concentración de EGF), racotumumab (debido a la falta de disponibilidad de los anteriores) y atezolizumab (enfermedad metastásica progresiva con baja concentración de EGF).
• Mutados: Pacientes en estadio IV con mutación del receptor del factor de crecimiento epidérmico, recibieron inhibidores de tirosina quinasa, como primera línea de tratamiento.
Procesamiento
El
análisis estadístico se realizó mediante el programa SPSS,
versión 25. Se empleó estadística descriptiva para resumir
las características de la muestra. Para las variables cualitativas, se
construyeron tablas de contingencia y se realizó un análisis de
frecuencias. Para las variables cuantitativas, se calcularon la media, mediana,
desviación estándar, valores máximo y mínimo, rango
y error estándar de la media para cada grupo de tratamiento. Se compararon
las proporciones mediante la prueba chi cuadrado para determinar la asociación
estadística entre las variables. Se analizó la variable sexo mediante
la distribución de frecuencias absolutas y proporciones expresadas en
porcentajes. Para la edad y el estado funcional ECOG, se calcularon la media,
mínimo y máximo, y se realizó una distribución agrupada.
Para el color de la piel, adicción tabáquica, histología,
etapa clínica y tratamiento realizado, se realizó la distribución
de frecuencias y la distribución agrupada. Los resultados se presentaron
en tablas y figuras, y se elaboraron conclusiones y recomendaciones basadas
en los objetivos del estudio.
En la presente investigación, se aplicaron las normas de buenas prácticas clínicas establecidas por el Ministerio de Salud Pública de Cuba, conforme a la regulación 165-2000(12) del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Además, el Consejo Científico y el Comité de Ética del Hospital Provincial Clínico Quirúrgico Docente "Faustino Pérez" aprobaron la investigación. Antes de comenzar el tratamiento, los pacientes y sus familiares firmaron un consentimiento informado. Por consiguiente, se garantizó que los resultados que podrían revelar la identidad de los pacientes no se publicarían, los datos se recopilaron sólo para cumplir con los objetivos declarados.
RESULTADOS
En la Tabla 1 se presentan las características demográficas de los pacientes. La distribución por sexo fue equitativa. Predominó el fototipo de piel blanco, lo cual representa el 84,2 % del total. En cuanto a la edad de presentación, el grupo etario de 70 a 79 años fue el más frecuente, con un 35,1 %. Un porcentaje significativo de los pacientes eran fumadores (57,0 %).
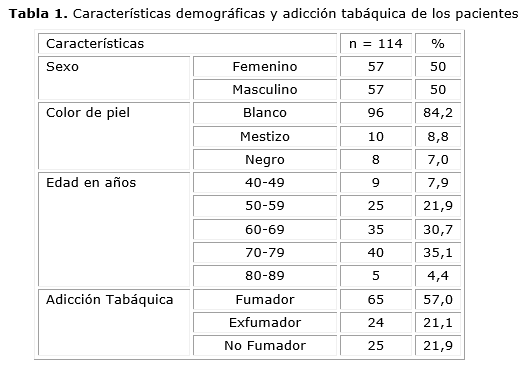
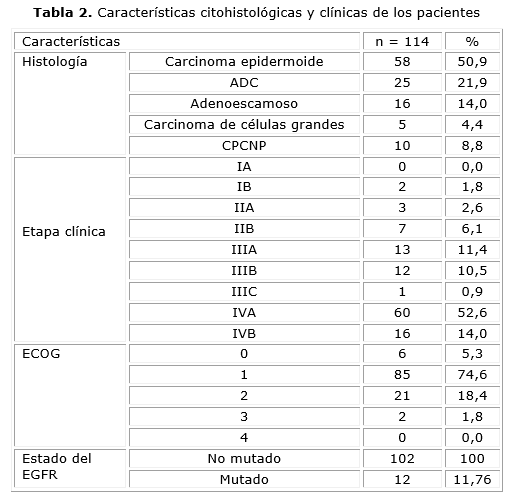
En la Tabla 2 se observa que el subtipo histológico predominante fue el carcinoma epidermoide, con un 50,9 %, seguido por el adenocarcinoma (ADC), con un 21,9 %. Predominaron las etapas avanzadas de la enfermedad, la etapa IVA fue la más frecuente al momento del diagnóstico, representa el 52,6 % del total. Además, se observa un predominio notable de individuos con un estado funcional Eastern Cooperative Oncology Group 1, que corresponde al 74,6 % de la muestra. El 11,76 % del grupo de pacientes presentó una mutación en el gen receptor del factor de crecimiento epidérmico.
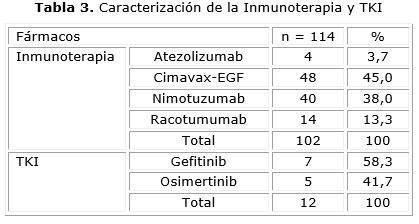
En la Tabla 3, se aprecia un predominio de la inmunoterapia activa, donde se utilizó la vacuna cubana Cimavax-EGF, en 48 pacientes, lo cual representa el 45,0 % de la totalidad de pacientes tratados con esta modalidad de tratamiento oncológico. Además, se observa que el 3,7 % de tales pacientes fueron tratados con atezolizumab.
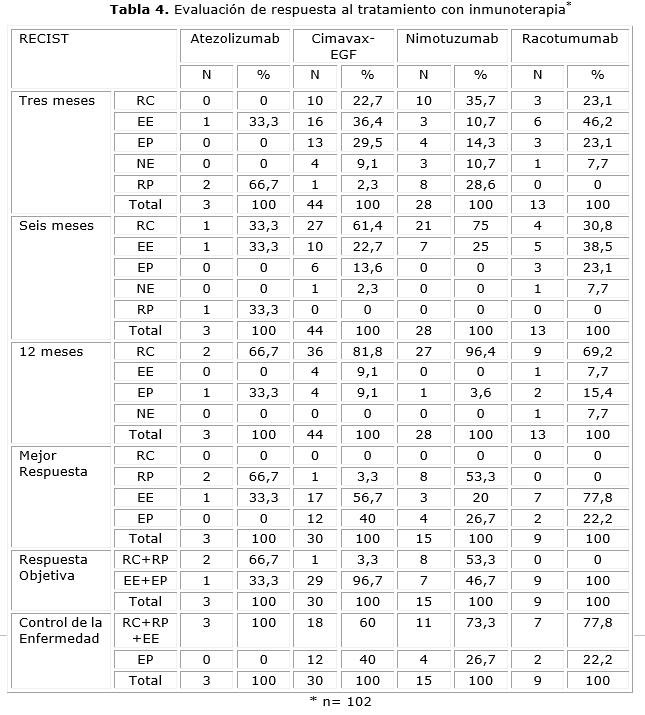
En la Tabla 4 se representan las evaluaciones de respuesta, de acuerdo a la inmunoterapia administrada. A los tres meses, la mejor respuesta con atezolizumab fue la respuesta parcial (66,7 %), mientras que con Cimavax-EGF fue la enfermedad estable (36,4 %). Con nimotuzumab, se observó la RC (35,7 %), y con racotumumab, la EE (46,2 %). A los seis meses, las respuestas con atezolizumab se igualaron (RC, RP, EE) (33,3 %). Con Cimavax-EGF predominó la RC (61,4 %), al igual que con nimotuzumab (75,0 %), mientras que con racotumumab la EE fue de (38,5 %). A los 12 meses, predominó la RC con atezolizumab (66,7 %), Cimavax-EGF (81,8 %) y nimotuzumab (96,4 %), la RC con racotumumab fue igual (69,2 %). En cuanto a respuesta objetiva (RC-RP), los mejores resultados se lograron con atezolizumab (66,7 %) y nimotuzumab (53,3 %). El control de la enfermedad (respuesta completa - respuesta parcial- enfermedad estable) se alcanzó en el 100 % de los casos con atezolizumab, 60 % con Cimavax-EGF, 73,3 % con nimotuzumab y 77,8 % con racotumumab.
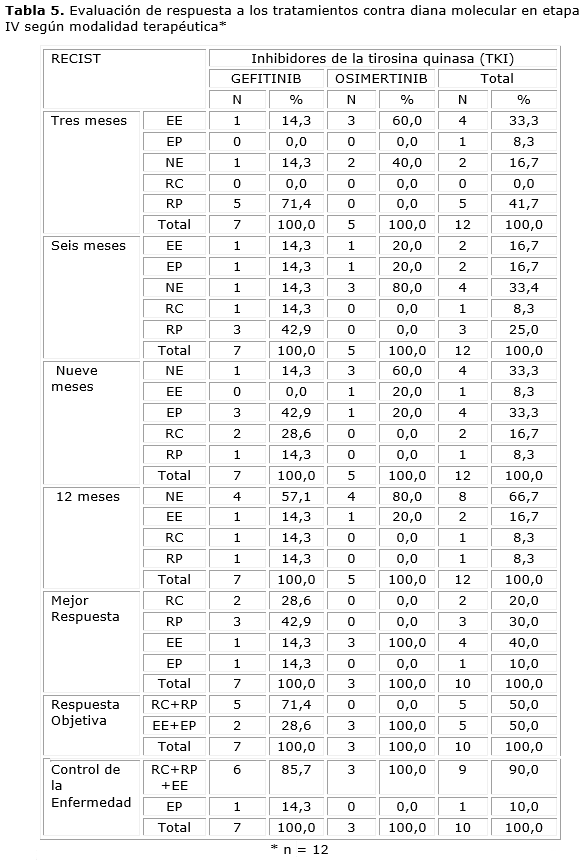
En la Tabla 5 se presentan los resultados de la respuesta al tratamiento con inhibidores de tirosina quinasa (TKI), dirigidos a dianas moleculares específicas. En términos generales, a los tres meses predominó la respuesta parcial (RP) (41,7 %). A los seis meses de tratamiento, la RP fue la respuesta más frecuente (25 %). A los nueve meses, la enfermedad progresiva (EP) fue la más observada (33,3 %) y, a los doce meses de tratamiento, la enfermedad estable (EE) representó el 16,7 %, mientras que el 66,7 % de los pacientes no fueron evaluables (NE). La mayor proporción de enfermedad estable a los tres meses se observó con osimertinib (60 %). A los seis meses, la mejor RP se obtuvo con gefitinib (42,9 %). A los nueve meses, gefitinib logró la mayor EP (42,9 %) y, a los doce meses, la mayor estabilidad de la enfermedad se alcanzó con osimertinib. La mejor respuesta objetiva se logró con gefitinib (71,4 %) y el mejor control de la enfermedad con osimertinib en el 100 % de los casos.
DISCUSIÓN
El cáncer de pulmón de células no pequeñas (CPCNP) se presenta con mayor frecuencia en hombres, en pacientes de tez blanca y en edades a partir de la sexta década de la vida. En la presente investigación, los porcentajes en cuanto al sexo se igualan,y los autores lo atribuyen al aumento del tabaquismo en mujeres. En cuanto al subtipo histológico, la incidencia difiere, pues en el resto de las provincias cubanas predomina el adenocarcinoma (ADC), mientras que en esta investigación prevalece el carcinoma epidermoide.(13)
El tabaquismo es la principal causa de esta enfermedad, con una relación directa de hasta el 90 % en hombres y el 85 % en mujeres. El riesgo relativo se aproxima al 17,8 % para los hombres y al 11,6 % para las mujeres. Gómez Tejeda(14) destaca que el hábito de fumar se presenta en el 64,29 % de los pacientes. En el estudio de Carballo Torres(14) se difundió que más del 50 % de los pacientes eran mayores de 65 años y de sexo masculino. La histología predominante fue el adenocarcinoma (ADC) con un 41,6 %, el 80 % se encontraba en las etapas IIIB y IVA, y el 85,8 % de los casos presentaron un Eastern Cooperative Oncology Group de 0-1.
La medicina personalizada y de precisión gana terreno, ofrece mejores respuestas a los tratamientos, mayor estabilidad y control de la enfermedad, mejor calidad de vida, más seguridad y una mayor supervivencia global para los pacientes.(16)
Desde la década de 1990, en Cuba se iniciaron estudios de ensayos clínicos con productos biotecnológicos para identificar blancos específicos y mejorar la eficacia. Entre los productos registrados para pacientes con CPCNP en etapas avanzadas, se encuentran CIMAvaxEGF, una vacuna terapéutica contra el factor de crecimiento epidérmico (registrada en 2008), y nimotuzumab, un anticuerpo monoclonal humanizado contra el receptor del factor de crecimiento epidérmico (registrado en 2018). Un tercer producto, racotumumab, cuenta con un registro condicionado desde 2013 y continúa en ensayos clínicos para la aprobación en estadios avanzados del cáncer de pulmón de células no pequeñas.(17)
En el presente estudio, se obtuvieron resultados similares a los de Carballo Torres,(15) quien, en una investigación con CimavaxEGF y nimotuzumab, constató mejores respuestas en la evaluación con nimotuzumab (RP en el 41,3 %) que con Cimavax EGF (29 %). De forma similar, Columbié Regüeiferos(18) difundió resultados semejantes en el estudio "Uso de la vacuna CIMAvax-EGF® como práctica médica habitual", tras la primera línea de tratamiento, donde sólo a siete pacientes (12,1 %) presentaron EP. Por otro lado, Paris(17) difundió en un estudio realizado en el Servicio Provincial de Oncología de Matanzas, con pacientes inmunizados en el período 2013-2018, que a los tres meses de tratamiento, la EP alcanzó los mayores porcentajes de respuesta en cada grupo de vacunas: 44,2 % en los tratados con racotumumab y 67,19 % en los de CIMAvax-EGF. A los seis meses, de los 55 pacientes que progresaron, 33 continuaron en progresión, cuatro presentaron una respuesta parcial y cuatro tuvieron estabilizaciones de la enfermedad.
Atezolizumab, un producto internacional, actúa sobre los puntos de control inmunológico y ha demostrado una supervivencia de 33 meses en el tratamiento de segunda línea del cáncer de pulmón de células no pequeñas, independiente del estado de expresión de PD-L1.(19)
Si se comparan los resultados con investigaciones realizadas con productos que presentan el mismo mecanismo de acción, Storino y otros(20) evaluaron la respuesta según RECIST, en 98 pacientes; las drogas utilizadas fueron nivolumab en 49 pacientes (45,3 %), pembrolizumab en 50 (46,2 %), atezolizumab en 6 (5,5 %) y la combinación de nivolumab con ipilimumab en 3 (3 %), de los cuales dos tuvieron RC (2 %), 36 RP (37 %), 40 EE (41 %) y 20 progresión de enfermedad (20 %). Predominó la estabilización de la enfermedad seguido de la respuesta parcial, en cambio en la presente investigación con atezolizumab predominó la respuesta parcial, seguida de la enfermedad estable.
Al comparar los resultados con investigaciones sobre productos con el mismo mecanismo de acción, Storino y otros(20) evaluaron la respuesta según RECIST, en 98 pacientes. Los fármacos utilizados fueron nivolumab en 49 pacientes (45,3 %), pembrolizumab en 50 (46,2 %), atezolizumab en 6 (5,5 %) y la combinación de nivolumab con ipilimumab en 3 (3 %), de los cuales 2 tuvieron RC (2 %), 36 RP (37 %), 40 EE (41 %) y 20 progresión de la enfermedad (20 %). En el estudio de Storino y otros, predominó la estabilización de la enfermedad, seguida de la respuesta parcial. En contraste, en la presente investigación con atezolizumab, predominó la respuesta parcial, seguida de la enfermedad estable.
En este estudio, la respuesta parcial (RP) fue la mejor respuesta observada en los pacientes tratados con nimotuzumab y atezolizumab. En cuanto a la estabilización de la enfermedad (EE), CIMAvax-EGF y racotumumab mostraron ser las opciones más eficaces. Los autores de la presente investigación consideran que estos son resultados alentadores, dado el creciente papel de la inmunoterapia en el tratamiento oncológico.
En cuanto a los tratamientos con inhibidores de la tirosina quinasa (TKI), la Sociedad Europea de Oncología Médica (ESMO) recomienda tres fármacos de primera línea para pacientes con cáncer de pulmón de células no pequeñas en estadio IV que presenten mutaciones del receptor del factor de crecimiento epidérmico (EGFR). Estos fármacos son gefitinib y erlotinib (medicamentos de primera generación) y afatinib (medicamento de segunda generación), todos derivados de la quinazolina que actúan como inhibidores intracitoplasmáticos del EGFR (EGFR-TKI). En la actualidad, osimertinib (medicamento de tercera generación) se considera la opción preferida como tratamiento de primera línea para pacientes con un tumor con mutación de receptor del factor de crecimiento epidérmico sensibilizante.(21,22)
Flores Vega(23) comunicó que los pacientes con adenocarcinoma de pulmón -con mutación del receptor del factor de crecimiento epidérmico- tratados con gefitinib, alcanzan altas tasas de respuesta con un impacto positivo en la supervivencia.
Sin embargo, los resultados presentes no coinciden con los de Eloy La Luz,(24) cuyo estudio sobre inhibidores de la tirosina quinasa muestra que, de los 13 pacientes (86,7 %) que recibieron tratamiento de primera línea y tuvieron exploraciones evaluables, 11 progresaron, uno tuvo enfermedad estable y otro tuvo una respuesta parcial. De igual forma, se difiere de Soria y otros,(25) quienes mencionan que la tasa de respuesta objetiva fue similar en los dos grupos: 80 % con osimertinib y 76 % con gefitinib o erlotinib, aunque la mediana de duración de la respuesta fue de 17,2 meses (IC del 95 %, 13,8 a 22,0) con osimertinib frente a 8,5 meses (IC del 95 %, 7,3 a 9,8) con los inhibidores de la tirosina quinasa estándar.
Por otro lado, Cáceres Lavernia(26) mostró resultados divergentes en una investigación, donde evaluaron a 26 pacientes. En el 69 % de los casos se obtuvo control de la enfermedad, con predominio de respuesta parcial (RP) en pacientes que recibieron osimertinib (41,7 %) y enfermedad estable en los que recibieron gefitinib (35,3 %), mientras que el mayor número de progresiones se observó en pacientes que recibieron gefitinib (23,5 %).
En estadios avanzados de cáncer de pulmón de células no pequeñas, los pacientes tratados con inhibidores de tirosina quinasa (TKI) mostraron mejor respuesta objetiva con gefitinib, mientras que osimertinib ofreció un control superior de la enfermedad. Respecto a la inmunoterapia en etapas avanzadas, atezolizumab demostró la mejor respuesta objetiva y control de la enfermedad, seguido por nimotuzumab.
AGRADECIMIENTOS
A Aida Jiménez Bosco y Reinaldo Peña Santana, por la revisión del presente informe investigativo.
REFERENCIAS
1.
Arrieta O, Cardona AF, Zatarain Barron ZL, Rolfo C, Ordoñez C, Ruíz
Patiño A, et al. Historia del cáncer de pulmón: desde Doll
y Hill hasta las terapias de precisión. Med [Internet]. 2021;43(1):107-39.
[acceso: 09/02/2025]. Disponible en: https://revistamedicina.net/index.php/Medicina/article/view/1589
2.
Cuba. Ministerio de Salud Pública (MINSAP). Anuario Estadístico
de Salud 2023 [Internet]. La Habana: MINSAP, Dirección Nacional de Estadísticas
de Salud; 2024. [acceso: 26/10/2024]. Disponible en: https://temas.sld.cu/estadisticassalud/2024/09/30/anuarioestadistico-de-salud-2023/
3.
Zavala Hoppe AN, Recalde Chávez JZ, Saldarriaga García AJ, Quiroz
Villafuerte WA. Epidemiología y factores de riesgo asociados al cáncer
de pulmón en los países de Latinoamérica y Europa. MQRInvestigar
[Internet]. 2024;8(1):1483-99. [acceso: 26/10/2024]. Disponible en: https://www.investigarmqr.com/ojs/index.php/mqr/article/view/957
4.
Valencia Rico CL. Cáncer de pulmón, tendencias desde la perspectiva
del cuidado. Revista Urug Enferm [Internet]. 2022;17(2):e504. [acceso: 26/10/2024].
Disponible en: http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S2301-03712022000101504&lng=es
5.
DeVita VT Jr, Lawrence TS, Rosenberg SA. Cancer: Principles and Practice of
Oncology. 11th ed. Philadelphia: Lippincott Williams & Wilkins; 2019. [access:
20/11/2024]. Available from: https://www.wolterskluwer.com/en/know/cancerprinciples-and-practice-of-oncology
6.
Cordova Sanchez GA, Ugarte Palacios CV, Ugarte Palacios NA, Morales Labre KO.
Cáncer de pulmón y su importancia en el diagnóstico primario.
RECIAMUC [Internet]. 2022;6(2):208-17. [acceso: 09/02/2025]. Disponible en:
https://reciamuc.com/index.php/RECIAMUC/article/view/854
7.
Flores López A, Morán Martínez J, Martínez Arroyo
S, Betancourt Martínez ND, Jiménez Villarreal J. Criterios de
evaluación en tumores sólidos (RECIST 1.1) en pacientes con cáncer
primario y/o metastásico o enfermedad metastásica recurrente.
Rev SCientifica [Internet]. 2018;16(1):8-12. [acceso: 20/11/2024]. Disponible
en: http://www.investigacionyposgrado.uadec.mx/site/wp-content/uploads/2020/07/2018-
Criterios-de-Evaluación-en-Tumores-Sólidos-1.1-RECIST-1.1-en-pacientes-con-Cáncer
Primario-yo-Metastásico-o-Enfermedad-Metastásico-o-Enfermedad-Metastásica-Recurrente.pdf
8.
Camacho Sosa K, Martí Coruña MC, Ferreira Moreno VG, García
Soto J, Alonso Lemus L, Carreño Rolando IE. Eficacia de la tomografía
en el seguimiento del cáncer de pulmón tratado con inmunoterapia
cubana. Rev Méd Electrón [Internet]. 2022;44(2):1-10. [Acceso:
9/02/2025]. Disponible en: https://revmedicaelectronica.sld.cu/index.php/rme/article/view/4685
9.
Rosique Aznar C, Valcuende Rosique A, Rosique Robles D, Sánchez Alcaraz
A. Relación entre la lactato deshidrogenasa y la supervivencia en pacientes
con cáncer de pulmón no microcítico que reciben inmunoterapia.
Granja Hosp [Internet]. 2024;S1130-6343(24):00151-X. [acceso: 26/10/2024]. Disponible
en: https://pubmed.ncbi.nlm.nih.gov/39358085/
10.
Rivasa S, Armiséna R. El cáncer de pulmón de células
no pequeñas en la era de la medicina de precisión. Rev Med Clin
Condes [Internet]. 2022;33(1):25-35. [acceso: 26/10/2024]. Disponible en: https://www.sciencedirect.com/science/article/pii/S0716864022000025
11.
Portuondo Maseda MT, Martínez Castellanos T, Delgado Pacheco J, García
Hernández P, Gil Alonso D, Mora Pardo JA, et al. Manual de enfermería
en prevención y rehabilitación cardiaca [Internet]. Madrid: Asociación
Española de Enfermería en Cardiología; 2009. [acceso: 26/10/2024].
Disponible en: https://enfermeriaencardiologia.com/wp-content/uploads/cap_02_sec_03.pdf
12.
MINSAP, CECMED. Resolución Ministerial No. 165/2000. Directrices sobre
Buenas Prácticas Clínicas en Cuba. La Habana: CECMED; 2021. [acceso:
26/10/2024]. Disponible en: https://www.cecmed.cu/sites/default/files/adjuntos/ambitor/ambreg-18.pdf
13.
JP Impresores. Diagnóstico y tratamiento del cáncer de pulmón
[Internet]. La Habana: Editorial Ciencias Médicas; 2020 [Acceso: 20/11/2020].
Disponible en: http://www.bvs.sld.cu/libros/programa_integral_cancer_pulmon/programa_cancer_pul
mon.pdf
14.
Gómez Tejeda JJ, Tamayo Velázquez O, Iparraguirre Tamayo AE, Diéguez
Guach RA. Comportamiento de los factores de riesgo de la neoplasia de pulmón.
Univ Méd Pinareña [Internet]. 2020;16(3):[aprox. 5 p.]. [acceso:
26/10/2024]. Disponible en: https://www.medigraphic.com/pdfs/revunimedpin/ump2020/ump203p.pdf
15.
Carballo Torres D, Nenínger Vinageras E, Soriano García JL, Saavedra
Hernández D, Viada González C. Supervivencia en pacientes con
cáncer pulmonar no microcítico avanzado en mantenimiento con CIMAvax-EGF®
o Nimotuzumab. Rev Cubana Oncol. 2021;19(1):e_112. [acceso: 26/10/2024]. Disponible
en: https://revoncologia.sld.cu/index.php/onc/article/view/112
16.
Camacho Sosa K, Pérez Manzano L, Alonso Lemus L, La Rosa Iznaga D, Viada
González C, Vega Jiménez J. Supervivencia de pacientes con cáncer
de pulmón en tiempos de COVID-19. Arch Hosp Univ "Gen Calixto García"
[Internet]. 2024;12(3):[aprox. 16 p.]. [acceso: 26/10/2024]. Disponible en:
https://revcalixto.sld.cu/index.php/ahcg/article/view/1344
17.
Paris Gómez D, Camacho Sosa K, La Rosa Iznaga D, Alonso Lemus L, García
Soto J, Curbelo Gutiérrez LE. Supervivencia de pacientes con cáncer
de pulmón en estadios avanzados tratados con inmunoterapia activa cubana.
Rev Cubana Oncol [Internet]. 2024;21:e39323. Disponible en: http://revoncologia.sld.cu/index.php/onc/article/view/39323
18.
Columbié Regüeiferos JC, Rosales Calas M, Torres Puentes S, Veranes
García M, Quintero Salcedo S. Uso de la vacuna CIMAvax-EGF® como
práctica médica habitual. MEDISAN [Internet]. 2019;23(2):219-31.
[acceso: 26/10/2024]. Disponible en: https://medisan.sld.cu/index.php/san/article/view/2323
19.
Socinski MA, Pennell NA. Best Practices in Treatment Selection for Patients
With Advanced NSCLC. Cancer Control [Internet]. 2016;23(4 Suppl):2-14. [access:
26/10/2024]. Available from: https://pubmed.ncbi.nlm.nih.gov/27842052/
20.
Storino J, Cerini M, Lupinacci L, et al. Inmunoterapia en Cáncer de Pulmón
Metastásico. Experiencia del Hospital Italiano de Buenos Aires. Oncología
Clínica [Internet]. 2020;25(1):1-5. [acceso: 26/10/2024]. Disponible
en: https://oncologiaclinica.aaoc.org.ar/index.php/oncologiaclinica/article/view/24
21.
Pohl V E, Pozo U S, Poblete C J, Muñoz M A, Segura B F. Tratamientos
de primera línea para pacientes estadio IV con adenocarcinoma pulmonar
de mutación EGFR. Rev Hosp Clín Univ Chile [Internet]. 2021;32(3):233-43.
[acceso: 26/10/2024]. Disponible en: https://revistahospitalclinico.uchile.cl/index.php/RHCUC/article/view/69537
22.
Vega Jiménez. Importancia de la autopsia clínica en los estudios
sobre mortalidad por tumores malignos [Internet]. Rev Cubana Med. 2021;60(3):e1662.
[acceso: 26/10/2024]. Disponible en: http://revmedicina.sld.cu/index.php/med/article/view/1662/2100
23.
Flores Vega YI, Paramo González DL, Lamadrid García J, Elejalde
Larrinaga ÁR, Martínez Ramírez A, Corrales Otero D, et
al. Gefitinib en adenocarcinoma de pulmón con mutación del receptor
del factor de crecimiento epidérmico: Presentación de caso [Internet].
Rev Cubana Oncol. 2022;20(2):e40294. [acceso: 09/02/2025]. Disponible en: http://revoncologia.sld.cu/index.php/onc/article/view/40294
24.
Eloy La Luz CE, Castillero F. Experiencia institucional en pacientes con cáncer
de pulmón de células no pequeñas con mutaciones de inserción
del exón 20 del receptor del factor de crecimiento epidérmico
(EGFR) [Internet]. RMDP. 2024;44(1):15-20. [acceso: 09/02/2025]. Disponible
en: https://www.revistamedica.org/index.php/rmdp/article/view/2331
25.
Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH,
et al. Osimertinib in Untreated EGFR -Mutated Advanced Non-Small-Cell Lung Cancer
[Internet]. N Engl J Med. RMDP. 2018;378(2):113-25. [access: 09/02/2025]. Available
from: https://pubmed.ncbi.nlm.nih.gov/29151359/
26.
Cáceres Lavernia HH, Rodríguez Varona LM, Nenínger Vinageras
E, et al. Tratamiento con inhibidores tirosina cinasa en pacientes con cáncer
de pulmón [Internet]. Rev Cubana Oncol. 2022;20(1):e_173. [acceso: 09/02/2025].
Disponible en: http://revoncologia.sld.cu/index.php/onc/article/view/173
Conflicto de interés
Los autores declaran que no existen conflictos de interés.
Financiación
Los autores declaran que no hubo financiación involucrado en este trabajo.
Contribución de los autores
Conceptualización:
Lisandry Alonso Lemus, Kirenia Camacho Sosa, Lilianys Arias Correa, Carmen
Elena Viada González, Junior Vega Jiménez, Humberto Alexis López
González.
Curación de datos: Lisandry Alonso Lemus, Kirenia Camacho Sosa, Lilianys
Arias Correa, Carmen Elena Viada González, Junior Vega Jiménez,
Humberto Alexis López González.
Análisis formal: Lisandry Alonso Lemus, Kirenia Camacho Sosa, Lilianys
Arias Correa, Carmen Elena Viada González.
Investigación: Lisandry Alonso Lemus, Kirenia Camacho Sosa, Lilianys
Arias Correa, Carmen Elena Viada González, Junior Vega Jiménez.
Metodología: Lisandry Alonso Lemus, Kirenia Camacho Sosa, Lilianys
Arias Correa, Carmen Elena Viada González, Junior Vega Jiménez.
Administración del proyecto: Lisandry Alonso Lemus, Kirenia Camacho
Sosa, Lilianys Arias Correa.
Recursos: Lisandry Alonso Lemus, Kirenia Camacho Sosa.
Supervisión: Lisandry Alonso Lemus.
Validación: Lisandry Alonso Lemus, Kirenia Camacho Sosa, Lilianys
Arias Correa, Carmen Elena Viada González, Junior Vega Jiménez.
Visualización: Lisandry Alonso Lemus, Kirenia Camacho Sosa.
Redacción - borrador original: Lisandry Alonso Lemus, Kirenia Camacho
Sosa, Lilianys Arias Correa.
Redacción - revisión y edición: Lisandry Alonso Lemus,
Kirenia Camacho Sosa, Lilianys Arias Correa, Carmen Elena Viada González,
Junior Vega Jiménez, Humberto Alexis López González.